Zjistěte, jak získat odbornou radu na diagnostiku a léčbu revmatických onemocnění.
Přes 260 dotazů už bylo zodpovězeno – přidejte se i Vy! 🎥 Více ZDE
Bolest u zánětlivých revmatických onemocnění
Autor: prof. MUDr. Karel Pavelka, DrSc.
Pod pojmem revmatická onemocnění se skrývá několik desítek klinických jednotek různé etiologie průběhu a prognózy. Zánětlivá revmatická onemocnění představují jenom menší část revmatických chorob, ale medicínsky i ekonomicky nejzávažnějších.
Bolest je nejdůležitějším symptomem zánětlivých revmatických onemocnění. Bývá i příznakem prvním a často i důvodem vyhledání lékařské pomoci. Bolest je často i důležitým stavebním kamenem diagnózy. Hodnocení bolesti je i součástí četných kompozitních indexů pro hodnocení účinnosti léčby. V tomto kontextu je hodnocení úlevy od bolesti ukazatelem spadajícím do kategorie tzv. pacientem reportovaných ukazatelů /Patient reported outomes-PRO/. Z pohledu pacientů pak dokonce ukazatelem s nejvyšší prioritou.
Je také nutné zdůraznit, že prvotním a zásadním krokem v léčbě bolesti u revmatiků je snížení aktivity základního onemocnění. Snížení aktivity zánětlivého onemocnění zpravidla vede ke snížení bolesti, ale u části nemocných bolest přetrvává. V tomto případě je nutná další analýza příčin bolesti, jak bude uvedeno dále.
Předmětem této přehledné publikace je analýza bolesti, její patogeneze, výskyt a léčba u nejčastějších zánětlivých revmatických onemocnění, tzn. revmatoidní artritidy, spondyloartritid a dnavé artritidy.
Revmatoidní artritida
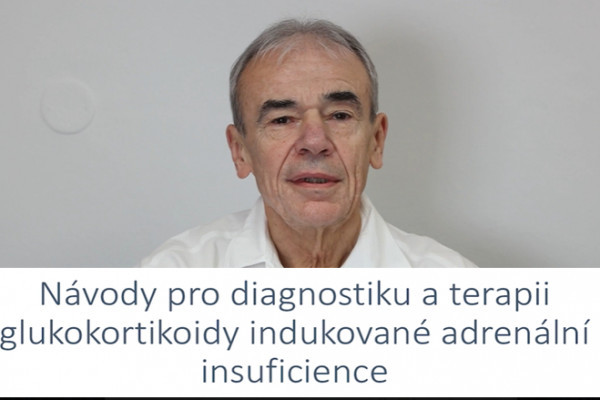
Revmatoidní artritida /RA/ je nejčastější, zánětlivé revmatické onemocnění postihující 0,8-1,0 % populace. RA je chronické, progresívní onemocnění, které zhoršuje kvalitu života, snižuje funkci, vyvolává disabilitu a také zkracuje život svých nositelů. Bolest může být u pacientů s RA přítomna neustále. Bylo prokázáno, že i u pacientů s dobrou odpovědí na protizánětlivou léčbu může být přítomna až u 30 % pacientů chronická bolest. Bolest také nejvíce ovlivňuje celkové emocionální zdraví. Na rozsáhlém modelu více než 15 tis. pacientů tvořila bolest velkou složku sledovaného psychosociálního zdraví /44 %/, zatímco aktivita onemocnění /RADI/ 23 % a funkční postižení /HAQ/ 22 %. Vztah mezi zánětem, bolestí a duševním zdravím je na obr. č 1 /1/.
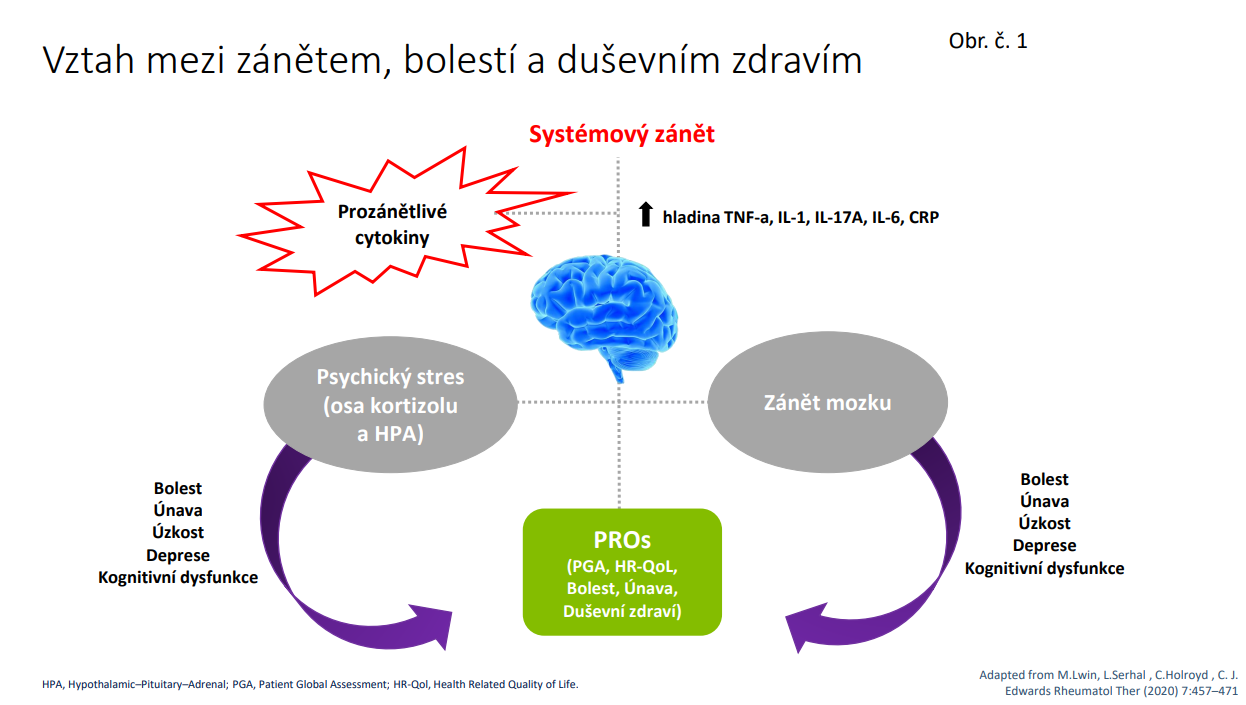
Bolest u RA má komplexní charakter a může být jak nociceptivního typu, tak i neuropatického typu. Převažuje sice nociceptívní bolest, která vzniká, když zánětlivé cytokiny, které jsou vylučovány lokálními imunitnímu buňkami spolu s dalšími mediátory, které působí na periferní nervová zakončení. V reakci na tyto zánětlivé mediátory se aktivují intracelulární signální dráhy, což vede k fosforylačním kaskádám, které mohou podporovat dlouhodobou maladaptivní plasticitu nervového systému. Hovoříme o periferní sensitizaci. Kromě zánětem vyvolaného zvýšení citlivosti periferních nervů v kloubu je u pacientů s RA přítomna i centrální sensitizace nebo zvýšená citlivost nociceptívních neuronů v centrálním nervovém systému na normální nebo podprahový vstup /2/. Důsledky centrální sensitizace zahrnují přetrvávající bolest a také zvýšenou citlivost na bolest v oblastech, které jsou distální nebo vzdálené od aktívního kloubu. /Obr.č 2/. Centrální sensitizace u RA také vede k fibromyalgii, která se vyskytuje až ve 20 % nemocných s RA a která není ovlivnitelná DMARD. /3/
Léčba revmatoidní artritidy
Léčba revmatoidní artritidy má být vždy komplexní včetně nefarmakologické léčby, cvičení, fyzikální léčby a edukce, nicméně dominantní roli má dnes farmakoterapie. Cílem léčby RA je navození remise, nebo stavu nízké aktivity, nejdůležitější skupinou léků schopných navodit remisi jsou tzv. chorobu modifikující léky /Disease modifying antirheumatic drugs-DMARDs/. Koncept modifikace choroby obsahuje kombinaci v úlevě od příznaků /zvláště bolesti/, zlepšení nebo normalizace funkce, zlepšení kvality života a sociální a pracovní kapacity a především zpomalení nebo zastavení strukturální progrese RA. /4/ Nejdůležitější strategií léčby RA je časná léčba, léčba k cíli /T2T/, která je založena na principech stanovení cíle léčby /remise nebo stav nízké aktivity/, dále na pravidelném hodnocení aktivity a adjustaci léčby pokud není cíle dosaženo. /5/. Dlouhodobě, ale zůstává 10-15 % pacientů s přetrvávající aktivitou, která se většinou prezentuje přetrvávající bolestí a únavností. Nově se tato skupina pacientů nazývá obtížně léčitelná (Difficult to treat – D2T). Tato skupina je nyní předmětem dlouhodobého klinického výzkumu.
Léčba bolesti u revmatoidní artritidy
Historicky se úloha NSA v léčbě RA změnila. Ještě v 70. letech minulého století se uznával tzv. pyramidální přístup k léčbě RA, někdy také charakterizovaný sloganem go low, go slow. V tomto přístupu se podávala NSA jako první lék u RA a k aplikaci tehdy dostupných DMARD a glukokortikoidů se přistupovalo až po určité době a selhání léčby NSA. Dnes se používá princip časné, agresívní léčby ihned po stanovení diagnózy a většinou spočívá v aplikaci MTX s krátkodobou léčbou glukokortikoidy. V této době je většinou nutné NSA používat, ale při rychlém zvládnutí aktivity bolest ustupuje a nutnost aplikace NSA se snižuje. Pacienti ve stavu remise či nízké aktivity používají NSA méně nebo vůbec. U části pacientů s RA bolest přetrvává a ti pak užívají NSA dlouhodobě. Zde je již nutné se vážně zabývat možnými nežádoucími účinky NSA, které jsou notoricky známé. COX 2 selektivní léky rozhodně nepřinesly tak výrazné zlepšení gastrointestinální tolerance, které slibovaly a naopak otevřely otázky zvýšeného kardiovaskulárního rizika. U pacientů s RA NSA selektivní i neselektivní zvyšují kardiovaskulární riziko /6/. Proto se doporučuje podávat NSA striktně on demand (čím méně tím lépe).
Efekt paracetamolu a dalších slabých analgetik a slabých opioidů /např. tramadolu/ nemá u RA příliš mnoho evidence a lze ho považovat za slabý. Lze je podávat v kombinaci s NSA, ve snaze snížit spotřebu NSA, nebo u pacientů s kontraindikacemi NSA.
Ve studii s časnou RA léčenou DMARD bylo zjištěno, že příčinou nedosažení remise byla přítomnost neuropatické bolesti. Při použití dotazníku na neuropatickou bolest PDQ byla zjištěna neuropatická bolest ve 13 % pacientů. Při přítomnosti neuropatické bolesti je pak vhodné postupovat podle odborných doporučení pro léčbu neuropatické bolesti.
Výrazný protizánětlivý, imunosupresívní a též analgetický efekt léčby RA glukokortikoidy /GK/ je znám 70 let a jeho objevitelé byly odměněni Nobelovou cenou - nicméně diskuse o poměru benefit/risk u léčby RA GK stále trvá. Některé konsenuální práce uvádějí, že při dávkování prednisonu 5 mg a méně denně převažuje benefit léčby GK, při dávce nad 10 mg prednisonu již převazuje riziko. Dávky mezi 5-10 mg se mohou lišit i jednotlivých pacientů. V reálné klinické praxi z registrů biologické léčby a kontrolních skupin je však známé , že GK užívá dlouhodobě systémově až kolem 40-50 % pacientů, spektrum možných nežádoucích účinků GK je široké, nicméně u RA vystupuje do popředí zvláště otázka glukokortikoidy indukované osteoporózy, vzhledem k populaci léčené, délce léčby, komedikaci a dalším rizikovým faktorům osteoporózy. V posledních Doporučeních EULAR jsou GK doporučovány pro léčbu časné, aktívní RA v kombinaci s MTX nebo dalšími DMARD jako přemosťující léčba s maximální délkou léčby 6 měsíců. /5/ Bohužel v běžné praxi toto není dodržováno. Někdy je možné pozorovat, že dávky GK jsou zvyšovány ke zvýšení analgetického efektu, přičemž zánět není objektivně přítomen /nejsou oteklé klouby, normální CRP, ev. sono/.
Glukokortikoidy lze u RA podávat i lokálně intraartikulárně. Tato léčba se uplatňuje především u nemocných s perzistující mono či oligoartritidou. Jde o léčbu účinnou a bezpečnou ale je nutné ovládat techniky i.a. léčby a minimalizovat rizika infekce. /6/
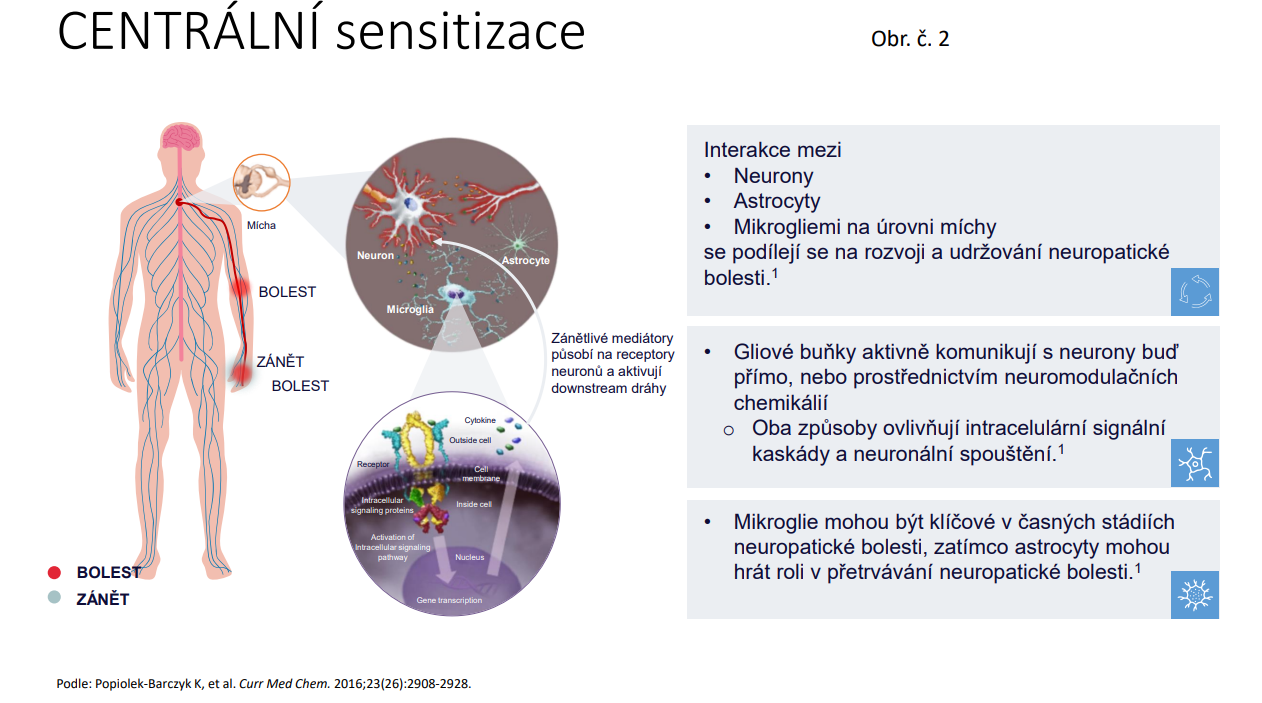
Za nejlepší způsob léčby bolesti lze považovat kauzální léčbu, tzn. maximální potlačení aktivity RA. Základním prostředkem k účinnému potlačení aktivity RA je aplikace DMARD, která má být časná, trvalá a cílená k dosažení remise či stavu nízké aktivity. Paleta DMARD se značně rozšířila. DMARD se nyní klasifikují podle původu /biologický, syntetický/ a podle cíleného působení. /Obr.č. 3/. V první linii léčby se doporučují tzv. konvenční syntetická DMARD /csDMARD/, kam patří MTX, sulfasalazin a leflunomid /ostatní csDMARD se používají zcela výjimečně/. Při selhání csDMARD se v druhé linii používají biologické DMARD, jejichž paleta se v posledních letech značně rozšířila. Podle mechanismu účinku se dělí na blokátory anti TNF, blokátory IL 6, blokátory Il-1, anti CD 20 léky, léky blokující aktivaci T lymfocytů /abatacept/. U léků, u kterých vypršela patentová ochrana byly syntetizovány tzn. biosimilární léky, které mají prokazatelně stejnou účinnost i bezpečnost jako referenční originální léky. /7/
V posledním desetiletí byly syntetizovány tzv. cílené syntetické léky /tsDMARD/, které jsou zcela odlišné od biologických léků. Jde o malé molekuly a léky jsou podávány perorálně. Intracelulárně blokují signální transdukci a tím proces aktivace jádra k syntéze prozánětlivých faktorů. Signální transdukci ovlivňují blokádou janusových kináz /JAK inhibitory /8/. V současné době jsou v distribuci inhibitor JAK 1,3 tofacitinib, inhibitor JAK 1,2 baricitinib a selektivní inhibitory JAK 1 upadacitinib a filgotinib. /9,10/ Ve srovnávacích studiích s anti TNF léky jsou nejméně tak účinné, nebo dokonce účinnější, ale nejsou zatím vyřešeny všechny otázky bezpečnosti jako je vznik herpes zoster nebo možná zvýšený výskyt trombembolismu. Nově byl zjištěn významný analgetický efekt JAK inhibitorů, který může být větší než u anti TNF léčby a částečně nezávislý od přímého protizánětlivého účinku. /11/ Na experimentálních modelech bylo zjištěno, že signalizace JAK zprostředkovává periferní i centrální sensitizaci. Inhibice signalizace JAK 1/3 snižuje bolest ještě před detekcí změn zánětlivých markerů. Tento nezávislý, přídatný anelgetický efekt, pokud se potvrdí by mohl být určitou komparativní výhodnou JAK inhibitorů.
Zavedení bDMARD A tsDMARD přineslo revoluci do léčby RA. Efekt této léčby je robustní, rychlý a splňuje všechna kritéria kladená na modifikaci choroby. Limitací této léčby je fakt, že až u 30 % pacientů není cíle dosaženo a hovoříme pak o refrakterní RA. Dalším problémem je výskyt sice řídkých, ale závažných nežádoucích účinků a dále stále dostupnost této léčby.
Spondyloartritidy
Spondyloartritidy /SpA/ tvoří skupina podobných a částečně se i překrývajících onemocnění postihující páteř /sakroiliitída a spondylitída,/, klouby /artritida, daktylitída/, šlachové úpony /entezitídy/ a též mimoskeletální struktury /psoriáza,idiopatické střevní záněty, uveitídy/. Podle novější klasifikace je dělíme na převážně axiální /radiografická ax SpA nebo také ankylosující spondylitída, non radiografická SpA/ a na převážně periferní /psoriatická artritida, reaktívní artritida/.
Základním příznakem ax SpA je bolest v dolních zádech vyvolaná zánětem sakroiliakálních kloubů. Při spondylitídě mohou pak bolesti postihovat všechny etáže páteře. Pro klasifikaci ax SpA byla navržena kritéria ASAS /Obr. č. 4/ /12/.

Základním kritériem je chronická bolest v dolních zádech trvající déle než tři měsíce u osob mladších 45 let. Dále lze splnit kritéria buď v tzv. větvi zobrazovací, kdy pacient má nález sakroiliitidy při zobrazovacích metodách /ale nemusí být na rtg, může být na MRI/ a jeden další příznak, nebo ve větvi klinické, kdy podmínkou je positivita antigenu HLA B 27 a přítomnost dalších dvou kritérií. Je nutné zdůraznit, že součástí kritérií je nová definice tzv. zánětlivé bolesti v zádech. /Obr.č. 5/.

Kritérií pro zánětlivou bolest v zádech bylo navrženo několik, nejčastěji se používají kritéria uvedena výše navržená skupinou ASAS. Je nutné ale zdůraznit, že zánětlivá bolest v zádech může upozornit na možnou spondyloartritidu, ale sama o sobě není dostatečně specifická ani sensitívní. Dále je nutné upozornit na problematiku interpretace nálezů na MRI sakroiliakálních kloubů. Základním nálezem typickým pro sakroiliitídu je obraz tzv. otoku kostní dřeně/bone marrow edema/. Vyskytují se však falešně positívní i negatívní nálezy a je nutné provádět MRI v centrech s dobrou znalostí této problematiky a vždy je dávat do kontextu dalších klinických i laboratorních nálezů.
Diagnóza tzv. non radiografické SpA je relativně nová a stále představuje určité problémy jak při diagnostice, tak při posuzování a léčbě. Klinické příznaky při radiografické fromě /AS/ a non radiografické formě jsou v něčem stejné a v něčem se liší. /Obr.č. 6/. Důležité ale je, že v řadě pacientem reportovaných ukazatelů včetně bolesti, jsou stejné a proto je nutné je léčit obdobně a to včetně užití biologické léčby, jak je uvedeno v nových Doporučeních pro léčbu ax SpA. /13/
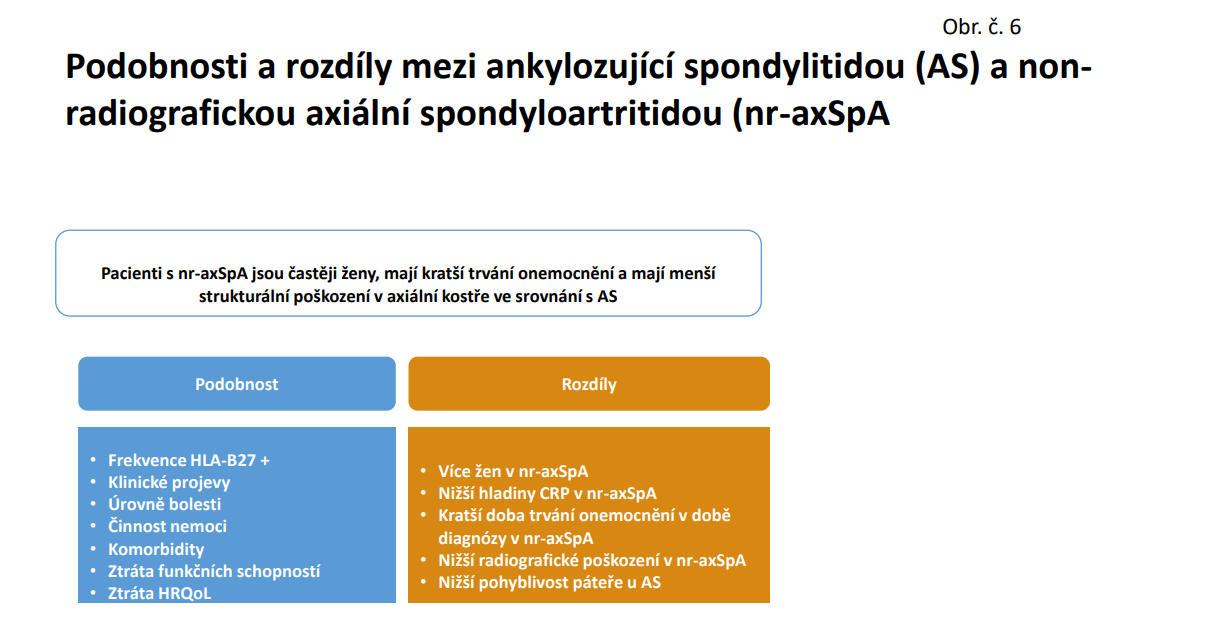
Nr ax SpA byla považována za určité časné stadium AS. Kohortové studie však ukazují, že progrese z non radigrafické do radiografické formy je relativně pomalá a činí kolem 15 % během 2 let. Prediktívními faktory progrese jsou vysoká aktivita SpA, vysoké reaktanty akutní fáze, přítomnost syndesmofytů na začátku léčby a také kouření. /14 /.
Léčba ax SpA
Léčba ax SpA by měla být vždy komplexní skládat se z léčby non farmakologické, farmakologické a ev. i chirurgické. Nefarmakologická léčba je u SpA asi nejdůležitější ze všech zánětlivých revmatických onemocnění. Do komplexu nefarmakologické léčby patří edukace pacientů, cvičení, fyzikální léčba, ergoterapie a komplexní lázeňská léčba. Každý pacient s SpA nezávisle na formě SpA, trvání nemoci, typu léčby a aktivitě by měl denně, celoživotně cvičit, aby nedocházelo ke ztuhnutí hrudníku a omezení funkce plic. Limitujícím faktorem cvičení může být kromě neochoty pacienta přítomnost komorbidit /např. kardiovaskulárních/ a dále bolest, která cvičení omezuje.
Léčba bolesti u ax SpA
Čistá analgetika patří mezi doporučované postupy u AS, i když jejich efekt je vzhledem k převážně zánětlivému typu bolesti slabý a lze je považovat jen za léky doplňkové. Problematika opiodů u SpA naráží na obecné problémy opioidů při léčbě chronické nenádorové bolesti. Evidence o účinnosti silných opiodů u AS je velmi málo /15/. Lze připustit jejich krátkodobou aplikaci při průlomových bolestech při AS např. pří vzniku kompresívní fraktury obratle, cervikální myelopatii, těžké koxitídě nebo v pooperačním období.
Lékem první volby při léčbě bolesti u ax SpA jsou nesteroidní antirevmatika /NSA/. V poslední době lze pozorovat určitý odklon od používání NSA v léčbě zánětlivých revmatických onemocnění jako např. u revmatoidní artritidy. Důvody jsou v podstatě dva: za prvé vzhledem k účinnější imunosupresívní léčbě je méně pacientů potřebuje a za druhé se získalo více dat o zvýšeném kardiovaskulárním riziku po NSA u těchto nemocných. Poněkud odlišná je situace u spondyloartritid, kde si NSA stále statut léku první volby u AS udržely. Pacienti s AS jsou většinou mladší muži, kteří mají méně komorbidit a především užívají menší množství léků než pacienti s RA, např. glukokortikodů, takže všeobecně je tolerance NSA při AS lepší než v jiných indikacích. Navíc byla získána evidence o tom, že dlouhodobá, kontinuální aplikace NSA /konkrétně celekoxibu/, může zpomalovat rentgenovou progresi AS. Novější studie s aplikací diclofenacu však strukturu modifikující efekt NSA nepotvrdily /16/. Dlouho se také vedly diskuse o tom, zda-li podávat NSA u AS kontinuálně denně nebo pouze při bolestech. Novější data spíše podporují podávání NSA na principu on demand, tedy pouze při bolestech. Lze používat jakákoliv NSA, ale vzhledem k povaze bolesti /např. nočním pesimům/ lze doporučit NSA s delším biologickým poločasem nebo retardované aplikační formy NSA.
Systémově podávané glukokortikoidy nemají evidenci o účinnosti u SpA a neměly by být podávány. Navíc mohou zhoršovat osteoporózu a zvyšovat riziko fraktury. Naopak lokální podání glukokortikoidů do kloubu se synovitidou či do entezitídy je doporučováno, protože má výrazný analgetický efekt.
Určitá evidence o účinnosti při potlačení zánětu u AS existuje u sulfasalazinu a ten by měl být aplikován u pacientů s AS a periferní polyartritidou. /17/
Revoluci do léčby AS přinesly zhruba před 20 lety anti TNF léky. Nejdříve to byl etanercept a infliximab, později adalimumab, certolizumab a golimumab. Anti TNF léky působí u AS mohutně, rychle a potlačují výrazně všechny komponenty aktivity SpA včetně CRP a FW, počtu oteklých kloubů a entezitíd na straně jedné a všech pacientem reportovaných ukazatelů na straně druhé to včetně bolesti. Kromě výsledků randomizovaných, placebem kontrolovaných studií to potvrzují i výsledky z kohortových studií a registrů /18/. K hodnocení účinnosti biologické léčby se používá validizované skóre BASDAI, které obsahuje 5 visuálních analogových škál hodnotících bolest a ztuhlost. Protože jde o hodnocení čistě subjektivních ukazatelů, bylo nově konstruováno skóre ASDAS, které kromě subjektivních ukazatelů obsahuje i CRP. Dle Doporučení České revmatologické společnosti je prahová hodnota pro zahájení biologické léčby BASDAI více než 4 + zvýšené CRP 2x, nebo alternativně ASDAS větší než 2,1. Rychlý a výrazný pokles BASDAI je možné dokumentovat např. z národního registru ATTRA. Léčba SpA by se měla řídit principy léčba k cíli /T2T/ přičemž nověji definovaným cílem je ASDAS méně než 1,3 nebo alternativně alespoň stavu nízké aktivity /ASDAS méně než 2,1/. Dobrého efektu lze docílit u přibližně 70 % pacientů s SpA, u 30 % dochází buď k primárnímu selhání /efektu není vůbec dosaženo/ nebo sekundárnímu selhání /efekt sice dosažen ale postupně se ztrácí/ u další části pacientů je léčba ukončena pro nežádoucí účinky. Při selhání léčby je při přetrvávající aktivitě vhodné switchovat na druhý biologický lék, kterým může být buď lék se stejným mechanismem účinku /anti TNF/ nebo s jiným mechanismem účinku. Druhým mechanismem účinku, který se ukázal být účinným u SpA je blokáda IL 17, a inhibitory IL 17 secukinumab a ixekizumab jsou již v běžné klinické praxi /19,20,21/. Spojená studie evropských registrů prokázala velmi výraznou redukci spotřeby NSA u pacientů léčených secukinumabem. Je velmi málo komparativních dat u účinnosti různých biologických léků u SpA. Na skupinové úrovni se zdá být účinnost antiTNF léků obdobná, rozdíly mohou být při subanalýze skupin pacientů s určitou manifestací. Pokud má pacient s SpA současně Crohnovu nemoc, vhodné jsou monoklonální protilátky anti TNF a nikoliv solubilní receptor etanercept, který na střevní záněty neúčinkuje. Účinnost IL 17 inhibitorů je na skeletální příznaky obdobná, také nejsou efektivní na idiopatické střevní záněty, ale zase lépe působí na psoriázu, pokud je přítomná. Je dobré, že paleta biologických léků se u SpA rozšířila a vzhledem k určitým rozdílům mezi nimi je možné při známe fenotypické pestrosti SpA individuálně vybrat pro pacienta nejvhodnější lék. /Obr.č. 7/.

Psoriatická artritida
Psoriatická artritida /PsA/ je progresívní, zánětlivé onemocnění skeletu, kůže a s řadou možných komorbidit, základními klinickými manifestacemi jsou artritida, daktylitída, entezitída a spondylitída. Typická je nesymetrická oligoartritida, artritida DIP kloubů, někdy i mutilující, entezitída v oblasti paty či kolene, příznaky spondylitídy jsou identické jako u spondyloartritidy. Závažnost se pohybuje od mírných, až po těžké, progredující a destruktívní formy. Artritida postihuje asi kolem 30 % pacientů s psoriázou. Z mimoskeletálních manifestací se u PsA vyskytuje často akutní přední uveitída a idiopatické střevní záněty. Z komorbidit je významné zvýšené kardiovaskulární riziko, deprese, zvýšená frekvence infekcí a obezita. Bolest kloubů, úponů a bolesti v zádech jsou nejčastějším příznakem PsA a úleva od bolesti je prioritou všech pacientů s PsA. I u PsA byl navržen koncept léčba k cíli, kterým může být buď remise nebo stav tzv. minimální aktivity nemoci /MDA/ který je v praxi přijatelnějším cílem. Ke splnění kritérií MDA je nutné splnit 5/7 kritérií, přičemž kritérium pro bolest je bolest menší než 15 mm na VAS 0-100 mm.
Léčba bolesti u PsA
Při léčbě periferní artritidy analgetiky, lokálními glukokortikoidy a NSA platí podobné principy, jako jsou u RA a SpA.
Z konvenčních csDMARD mají evidenci o účinnosti u PsA leflunomid, MTX a sulfasalazin. Ovlivňují především artritidu, není příliš evidence o ovlivnění daktylitídy, entezitídy, axiálních příznaků a vlivu na strukturální progresi PsA. /22/
Kontraversní je pohled na postavení systémově podávaných glukokortikoidů v léčbě PsA. Na jedné straně existuje evidence o jejich účinnosti na artritidu při PsA, na druhé straně ale je známý fakt exacerbace psoriázy při ukončení léčby PsA glukokortikoidy. V Doporučeních EULAR je pohled na systémově podávané glukokortikoidy spíše negativní. /23/
Podobně jako u RA a SpA i u PsA přinesla zásadní revoluci do léčby PsA biologická léčba. První byla schválena anti TNF léčba a tuto indikaci mají všechny anti TNF léky. Opět je nutné zdůraznit robustní a rychlý účinek a zlepšení všech ukazatelů aktivity včetně PRO a také samozřejmě úlevu od bolesti. Anti TNF léčba ovlivňuje všechny skeletální manifestace PsA /artritidu, entezitídu, daktylitídu, spondylitídu/, ale i extraskeletální manifestace PsA /uveitídu, psoriázu a IBD s výjimkou etanerceptu/. Paleta biologických léků u PsA se značně rozšířila a registrovány jsou: anti TNF, anti IL 17A, anti IL17A-F, anti IL/23, anti IL 23/. V loňském roce byly zaregistrovány pro léčbu PsA risankizumab a guselkumab, které mohou mít komparativní výhodu v nutnosti méně časté s.c aplikace /24, 25/. /Obr.č. 8/. Pro mírné formy PsA je možné použít syntetický lék apremilast. Nově byly na základě úspěšných studií fáze 3. registrovány v indikaci PsA inhibitory janusových kináz /JAK inhibitory/ tofacitinib, upadacitinib. /26,27/. V přímé srovnávací studii byl upadacitinib v kombinaci s MTX účinnější než adalimumab s MTX /28/. Otázkou zůstávají některé bezpečnostní faktory léčby JAK inhibitory.

Dnavá artritida
Dnavá artritida je zánětlivé, metabolicky podmíněné, krystaly indukované onemocnění. V důsledku zvýšené hladiny kyseliny močové dochází k její krystalizaci ve formě krystalů natrium urátu v kloubních tkáních a v ledvinách. Depozita krystalů natrium urátu v kloubech jsou fagocytovány polymorfonukleárními buňkami, vzniká tzv. inflamasom a jsou aktivovány mechanismy vrozené imunity, přičemž nejdůležitějším cytokinem je IL-1.Typickým projevem je potom akutní dnavý záchvat.
Akutní dnavý záchvat /podagra/ postihuje v 70 % I MTP na noze /kořenový kloub palce nohy/. Druhým v pořadí je kotník, dále koleno, ale může to být jakýkoliv kloub. Nejčastější formou artritidy je monoartritida, ale může jít i o oligoartritidu či polyartritidu. Trvání záchvatu je od několika dní do 4-6 týdnů. Následuje tzv. interkritické období, které může /nebo nemusí/ být ukončeno dalším záchvatem. Jenom malá část pacientů /kolem 5 %/ přejde do stadia chronické dny, většinou asociované s tvorbou tofů a možných destrukcí kloubů. Zlatým diagnostickým standardem dny je průkaz krystalů natrium urátu ve výpotku v polarizačním mikroskopu, kde jeví silnou negativní dvojlomnost. Pokud není dostupná krystalografická analýza je vhodné stanovovat diagnózu na základě kombinace klinických kritérií. A kdy na dnu myslet? Při artritidě I. MTP, zarudnutí nad kloubem, při jakékoliv artritidě nejasné etiologie, při monoartritídě, při artritidě u mužů středního a vyššího věku zvláště při výskytu tzv. asociovaných onemocnění /obezita, hypertense, dyslipidémie, alkoholismus/, při rodinné anamnéze dny, při onemocnění ledvin, při užívání některých léků /malé dávky aspirinu, diuretika, cyklosporin/. V diagnóze mohou pomoci zobrazovací metody, ale klasické rentgenové změny při dně se vyskytují až v pozdním průběhu a u malé části pacientů. Časnější diagnostiku může přinášet ultrazvuk, kde typickou morfou je nález tzv. dvojité kontury.
Terapie bolesti u dnavé artritidy
Akutní dnavý záchvat přináší velmi intenzívní bolest, často pacienty označovanou za krutou. Protože akutní dnavý záchvat vzniká náhle v noci, pacienti často uvádějí, že bolest byla tak silná, že neunesli ani tlak přikrývky.
Jednou z charakteristik bolesti u dnavého záchvatu je kromě intenzity a epizodičnosti a fakt, že je nejhorší hned na začátku záchvatu tzn. první či následující den. Proto by protizánětlivá a analgetická léčba by měla být zahájena ihned.
Pro léčbu zánětu a bolesti máme při dnavé artritidě v podstatě tři alternativy a to nesteroidní antirevmatika, kolchicin a glukokortikoidy.
Nejčastěji užívanou alternativou při léčbě akutní dny jsou nesteroidní antirevmatika. V podstatě lze užít jakékoliv NSA, ale nejvíce se používá diclofenac, indometacin, z COX2 selektívních má studii i dny etoricob. Důležité je však dávkování NSA, které se liší oproti jiným indikacím v revmatologii. Používají se jednak vysoké dávky, které již mají kromě analgetického efektu i evidentní protizánětlivý efekt, a dále se používají tyto dávky od začátku léčby a po odeznívaní bolesti se dávky snižují. Příkladem iniciální dávky NSA může být 150 mg diclofenacu nebo 1600 mg ibuprofenu. K redukci dávky může dojít většinou již po 3-7 dnech, ale ne u všech pacientů. NSA se používají u pacientů většinou s již diagnostikovanou dnou a samozřejmě pokud nejsou kontraindikace k jejich podávání.
Kolchicin je historický lék dny, který se dnes používá v léčbě akutního dnavého záchvatu méně. Je to mitotický jed, který paralyzuje funkci polymorfonukleárů a tím tlumí zánět. Jeho výhodou je relativní specifičnost účinku na dnu, takže může někdy pomoci v diagnostických rozpacích. Používá se také jako lék volby u nemocných, kteří nemohou používat NSA. Výraznou nevýhodou kolchicinu je výskyt nežádoucích účinků a to především gastrointestinálních a zvláště průjmů. V dříve používaných dávkovacích schématech mělo při nástupu účinku až 80 % velmi nepříjemné průjmy. Dříve navrhovaná dávkovací schémata byla podání bolus 1 mg tabl. a po 2 hod 0,5 mg do celkové denní dávky 5-6 mg. Některé novější studie navrhují tzv. zkrácené schéma, které spočívá v podání 1 mg a následně 0,5 mg za 2 hodiny. Dnes se kolchicin více používá v preventivní léčbě po zahájení hypourikemické léčby v dávce 0,5 mg denně ke snížení frekvence nových záchvatů.
Třetí alternativou léčby dnavého záchvatu je podání glukokortikoidů. První možností je lokální nitrokloubní aplikace depotního glukokortikidu např. Depomedrolu. Nejčastěji se používá u lokalizace v koleni, kde je přístup celkem jednoduchý. Získaná synoviální tekutina při proceduře může navíc být použita ke krystalografické analýze. Ošetřující lékař si ale musí být jist diagnózou dny, pokud by aplikoval glukokortikoidy do septického kloubu, mohl by pacienta významně poškodit. Glukokortikoidy se dají podat i systémově ve střední dávce 20-40 mg denně, část lékařů ale tento postup odmítá, protože se obává tzv. rebound fenomenu po vysazení glukokortikoidů. Indikací mohou být opět pacienti, kteří nemohou užívat NSA.
V případech refrakterní dny a selhání výše zmíněných způsobů léčby je možné aplikovat biologický lék a to konkrétně inhibitor IL 1 canakinumab s.c. léčba je velmi nákladná a je podmíněna souhlasem revizního lékaře. /29/
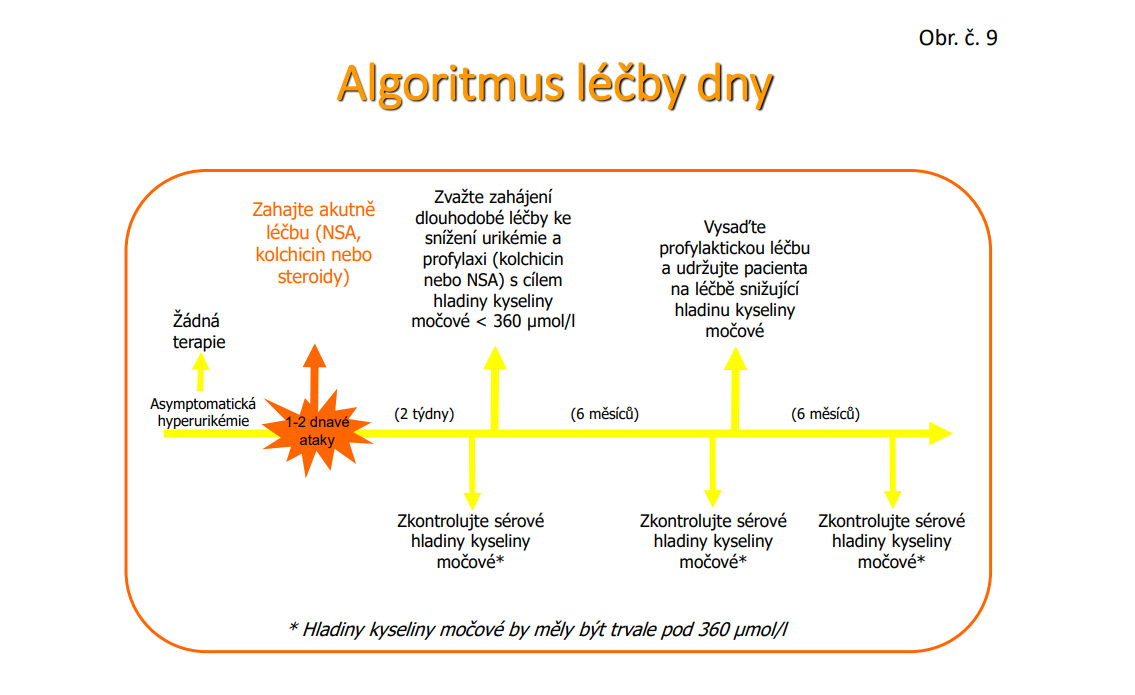
Stále platí pravidlo, i když je někdy zpochybňováno, že během probíhajícího záchvatu se nemá měnit léčba hyperurikémie. U pacientů, kteří urikostatika či urikosurika neužívají, zahájit léčbu až po odeznění záchvatu, u pacientů kteří je užívají léčbu neměnit a též až po odeznění záchvatu. Strategie léčby dny je schematicky na /Obr.č. 9/.
Závěr
Základem dobré léčby bolesti u zánětlivých revmatických onemocnění je již správný anamnestický rozbor bolesti vyhodnocení její intenzity, okolností za jakých vzniká, její vývoj, přítomnosti dalších indikátorů zánětu /oteklých kloubů, CRP, nálezu na sono či MRI/. Pouhé vyhodnocení intenzity bolesti a používání známého analgetického žebříku má u těchto onemocnění jen částečný význam. Nicméně při chronizaci bolesti je vhodné přístup modifikovat a týmová, multioborová spolupráce je optimálním řešením. /30/
Literatura
1. Lwin MN, Serhal L, Holroyd C, Edwards CJ. Rheumatoid Arthritis: The Impact of Mental Health on Disease: A Narrative Review. Rheumatol Ther. 2020 Sep;7(3):457-471. doi: 10.1007/s40744-020-00217-4.
2. Popiolek-Barczyk K, Mika J. Targeting the Microglial Signaling Pathways: New Insights in the Modulation of Neuropathic Pain. Curr Med Chem. 2016;23(26):2908-2928. doi: 10.2174/0929867323666160607120124.
3. Harte SE, Harris RE, Clauw DJ. The neurobiology of central sensitization. JOURNAL OF APPLIED BIOBEHAVIORAL RESEARCH 2018. 23 (2): e12137. DOI: 10.1111/jabr.12137
4. Smolen J a spol.: EULR recommendations for the management of rfheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs:2019 update.Ann Rheum Dis 2020,79:685-699
5. Smolen J a spol: Treating rheumatoid arthritis to target:2014 update of the recommendation of an international Task Force Ann Rheum Dis 2016,75:3-15
6. Šenolt L. za kol. ČRS, Mann H, Tomčík M, et all. Doporučené postupy České revmatologické společnosti pro farmakologickou léčbu revmatoidní artritidy – aktualizace v roce 2024. Česká revmatologie. 2024,32(1):7-24.
7. Kay J . a spol: Consensus based reccommendations for the use of biosimilars to treat rheumatological diseases.Ann Rheum Dis 2017,0:1-10
8. Wollenhaupt J., Lee EB a spol.: Safety and efficacy of tofacitinib for up to 9,5 years in the treatment of rfheumatoid arthritis Arthritis Res Ther 2019,21:89
9. Smolen J. a spol: Upadacitinib as monotherapy in patients with active rheumatoid arthritis and inadequate response to methotrexate /SELECT MONOTHERAPY/, double blind phase 3 study,Lancet 2019,393:2303-11
10. Combe B a spol.: Efficacy and safety of filgotinib for patients with rheumatoid arthritis with inadequate response to MTX:FINCH 1 52 results,Ann Rheum Dis 2020, 79/Suppl 1/: 316-317
11. Fleischmann R, Pangan AL, Song IH, et al. Upadacitinib versus placebo or adalimumab in patients with rheumatoid arthritis and an inadequate response to methotrexate: results of phase 3, double-blind, randomized controlled trial. Arthritis Rheumatol 2019;71:1788-800
12. Sieper J, Rudwaleit M, Baraliakos X, et al. The Assessment of Spondyloarthritis International Society (ASAS) handbook a guide to asses spondyloarthritis. Ann Rheum Dis 2009;68:Suppl 2ii-44
13.Ramiro S, Nikiphorou E, Sepriano A, et all. ASAS-EULAR recommendations for the management of axial spondylostrhritis: 2022 update. Ann Rheum Dis 2023. 82(1):19-34.
14. Ramiro S, Stoljwijk C, Van Tubergen A, et al. Evolution of radiographic damage in ankylosing spondylitis: A 12 year prospective follow-up of the OASIS study. Ann Rheum Dis 2015;74:52-59
15. Pavelka K a Výbor české revmatologické společnosti. Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartritid. Česká revmatologie 2021;1:5-19
16. Sieper J., Listing J., Poddubnyy D a spol.” Effect of continuous versus on demand treatment of ankylosing spondylitis with diclofenac over 2 years on radiographic progression of the spine” results from a randomised multicentre trial/ENRADAS/.Ann Rheum Dis 2016,75:1438-43
17. Chen J, Liu C. Sulfasalazine for ankylosing spondylitis. Cochrane Database Syst Rev 2005,(2)CD0004800
18. Ward MM., Deodhar A., Gensler LS a spol: 2019 Update of the American College of Rheumatology /Spondylitis Association of America/Spondylarthritis Research and Treatment Network Recommendations for the treatment of ankylosing Spopndylitis and Nonradiographic Axial Spondyloarthritis Arthritis Rheumatology 71,10mOctober 2019,s1599-1613
19. Pavelka K, Kivitz A, Dokoupilová E, Blanco R, Maradiaga M, Tahir H, Pricop L, Andersson M, Readie A, Porter B. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double-blind phase 3 study, MEASURE 3. Arthritis Research and Therapy 2017;19:285; DOI:10.1186/s13075-017-1490-y
20. Van der Heide D. a spol.: Ixekizumab, an interleukin 17 antagonist in the treatment of AS or radiographic axial spondyloarthritis in patients previously untreated with biological disease modifying anti- rheumatic drugs/COAST-V/:216 week results of phase 3 randomised , double blind m-, active controllled and placebo- controlled trial, Lancet 2018,4332, s. 241-251.
21. Deodhar a spol., Long-Term Safety and efficacy of ixekizumab in patients in ax SpA. 3-ear from COAST programme. J. Rheumatol. 2023 doi:103899/jrheum.221022.
22. Kingsley GH, Kowalczyk A, Taylor H, et al. A randomized placebo – controlled trial of methotrexate in psoriatic. Rheumatology 2012;51:1368-77.
23. Gossec L, et al. EULAR recommendations for the management of psoriatic arthritis eith pharmacological therapies: 2019 update, Ann Rheum Dis 2020;79:700-712.
24. Coatest. Efficacy and safety of guselkumab in patient with active psoriatic arthritis who are inadecuate respondens to TNF inhibitors. Ann Rheum. Dis 2021;0:0-11
25. Kristensen LE, a spol.: Efficacy and safety of risankizumab for active psoriatic arthritis: 24-wek results from the randomised, double blind, phase 3 KEEPsAKE 1 trial. Ann Rheum Dis 2021,0:1-7
26. Gladman D, Rigby W, Azevedo VF, et al. Tofacitinib for psoriatic arthritis in patients with an inadequate response to TNF inhibitors. N Engl J Med 2017;377:1525-36
27. Mease p. et al., Upadacitinib for psoriatic arthritis refractory to biologics: SELECT-PsA 2, Ann. Rheu. Dis. 2020;0:1-9
28. Mc Junes; et al. Trial of upadacitinib and adalimumab to psoriatic arthritis. Neo Engl. J. Med. 2021;384:1227-1239
29. Schlesinger N, Alten RE, Bardin T, et al.: Canakinumab for acute gouty arthritis in patients with limited treatment options: results from two randomised, multicentre, active controlled, double blind trials and their initial extensions. Ann Rheum Dis 2012;71:1839-1848
30. Pavelka K. Bolest u zánětlivých revmatických onemocnění, Farmakoterapie, 6/2022, 700-709